Promouvoir les gestes barrières, fermer les écoles ou réduire les rassemblements et les déplacements sont des exemples de mesures instaurées pour ralentir la diffusion d’un virus. En ralentissant la diffusion de l’épidémie, ces mesures permettent aussi de soulager le système de soins.
L’idée d’“aplatir la courbe” a été relayée par de nombreux journalistes et politiques pour justifier l’intérêt des gestes barrières, de la distanciation sociale ou des mesures de confinement (cf. #flattenthecurve sur Twitter), notamment pour éviter la surcharge dans les services de réanimation des hôpitaux. Mais pourquoi l’aplatissement d’une courbe serait-il une bonne nouvelle pour les hôpitaux, surtout si finalement le même nombre de personnes se trouvent infectées ?
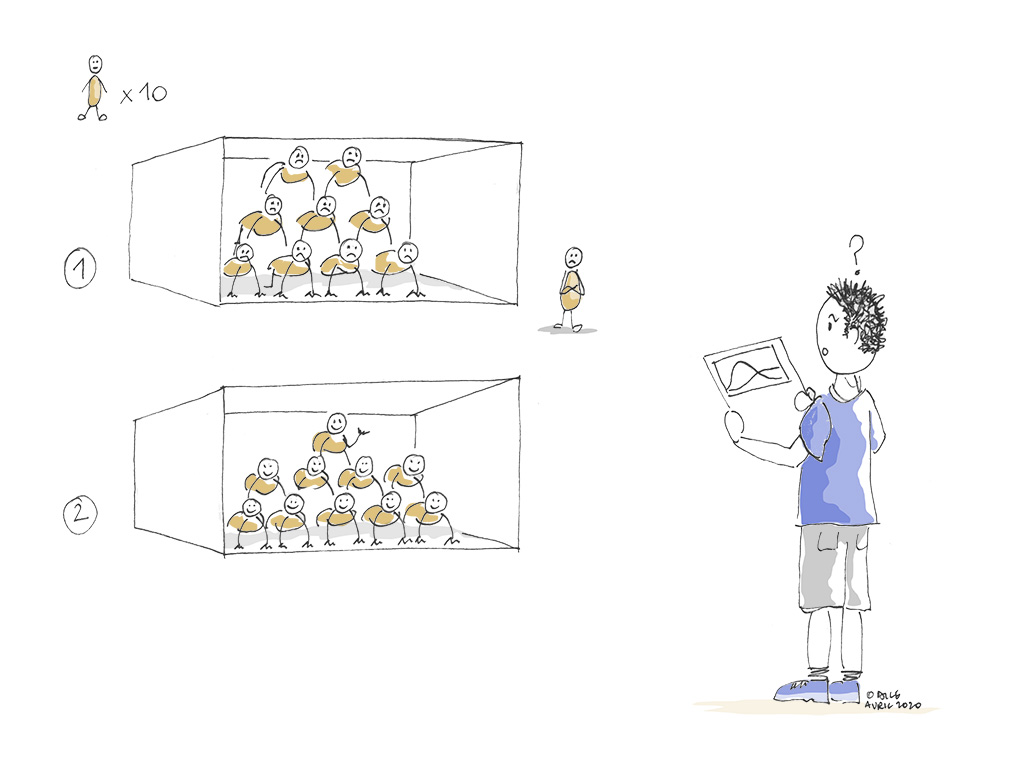
En fait, derrière cette volonté d’aplatir la courbe du nombre de cas, il y a l’idée de se donner plus de temps. Il s’agit d’étaler le nombre d’infections dans le temps (en réduisant la vitesse de diffusion du virus dans la population) pour éviter que les cas graves qui nécessitent une hospitalisation n’arrivent en même temps à l’hôpital et que leur nombre ne soit supérieur aux capacités humaines et matérielles (nombre de soignants, de lits, de matériel…) disponibles.
Commençons donc par observer l’évolution de la surcharge hospitalière selon qu’on ralentit ou non la vitesse de transmission du virus avec par exemple l’application de gestes barrières ou d’un confinement.
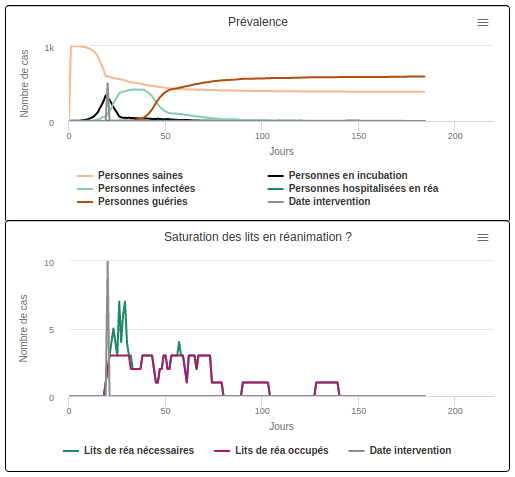
Sur la petite vidéo ci-dessous (scénario A1), on voit ce qui se passe si rien n’est fait pour ralentir la vitesse de diffusion : on observe un pic épidémique important (en bleu clair sur la figure “prévalence”) et un fort besoin en lits de réanimation (la courbe en bleu foncé sur la figure “Saturation des lits en réanimation ?”). Ce besoin en lits n’est qu’en partie comblé : la courbe des lits nécessaires est pendant 19 jours au dessus de la courbe en violet représentant le nombre de lits occupés. Tout ce qui se situe entre ces deux courbes représente le nombre de lits qu’il manque pour répondre aux besoins d’hospitalisation de la population. De fait, après la disparition du virus, ce sont seulement 22,5% des individus qui ont obtenu le lit de réanimation dont ils avaient besoin.
Scénario A1 Pas de ralentissement de la diffusion
Sur la simulation suivante (scénario A2), on choisit de ralentir la transmission dès que le premier cas grave est hospitalisé. Dans ce cas, on observe un aplatissement du pic épidémique mais aussi du besoin en lits de réanimation. L’hôpital se retrouve surchargé pendant moins longtemps (9 jours) et la proportion d’individus qui obtiennent un lit de réanimation dont ils ont besoin augmente (43,8%).
Scénario A2 Ralentissement de la diffusion à la première hospitalisation
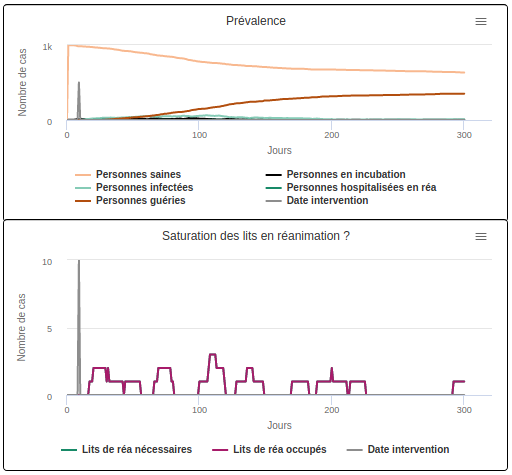
Et enfin la dernière simulation (scénario A3) correspond à la situation très idéaliste où l’épidémie aurait pu être ralentie dès l’apparition du premier cas. Dans ce cas, le pic épidémique disparaît quasiment et aucune surcharge hospitalière n’est observée : les courbes correspondant au nombre de lits nécessaires et au nombre de lits occupés se confondent. Aucune surcharge hospitalière n’est observée. 100% des individus en ayant besoin obtiennent un lit en réanimation.
Scénario A3 Ralentissement de la diffusion au premier cas infecté
Selon que la transmission est ralentie au début de l’épidémie ou bien plus tardivement, les pics épidémique et de surcharge hospitalière ne seront pas “aplatis” de la même façon. Cela illustre pourquoi l’aplatissement des courbes épidémiques est différent selon les pays en fonction du moment où la vitesse de transmission est ralentie. Cela illustre également pourquoi des mesures visant à limiter la transmission et instaurées au même moment dans tout un pays peuvent avoir des impacts variés dans les régions, selon le nombre de personnes déjà infectées localement au moment où le ralentissement est opéré.
Les simulations que nous présentons ci-dessus utilisent des paramètres reproduisant ce que l’on sait actuellement de la COVID-19, en lien avec les traitements dont on dispose pour l’instant. Cependant, on n’observerait pas forcément les mêmes dynamiques de propagation (et donc d’aplatissement de la courbe) pour d’autres virus. L’évolution de la maladie et sa gravité sont propres à chaque virus, c’est ce que représente le schéma ci-dessous.
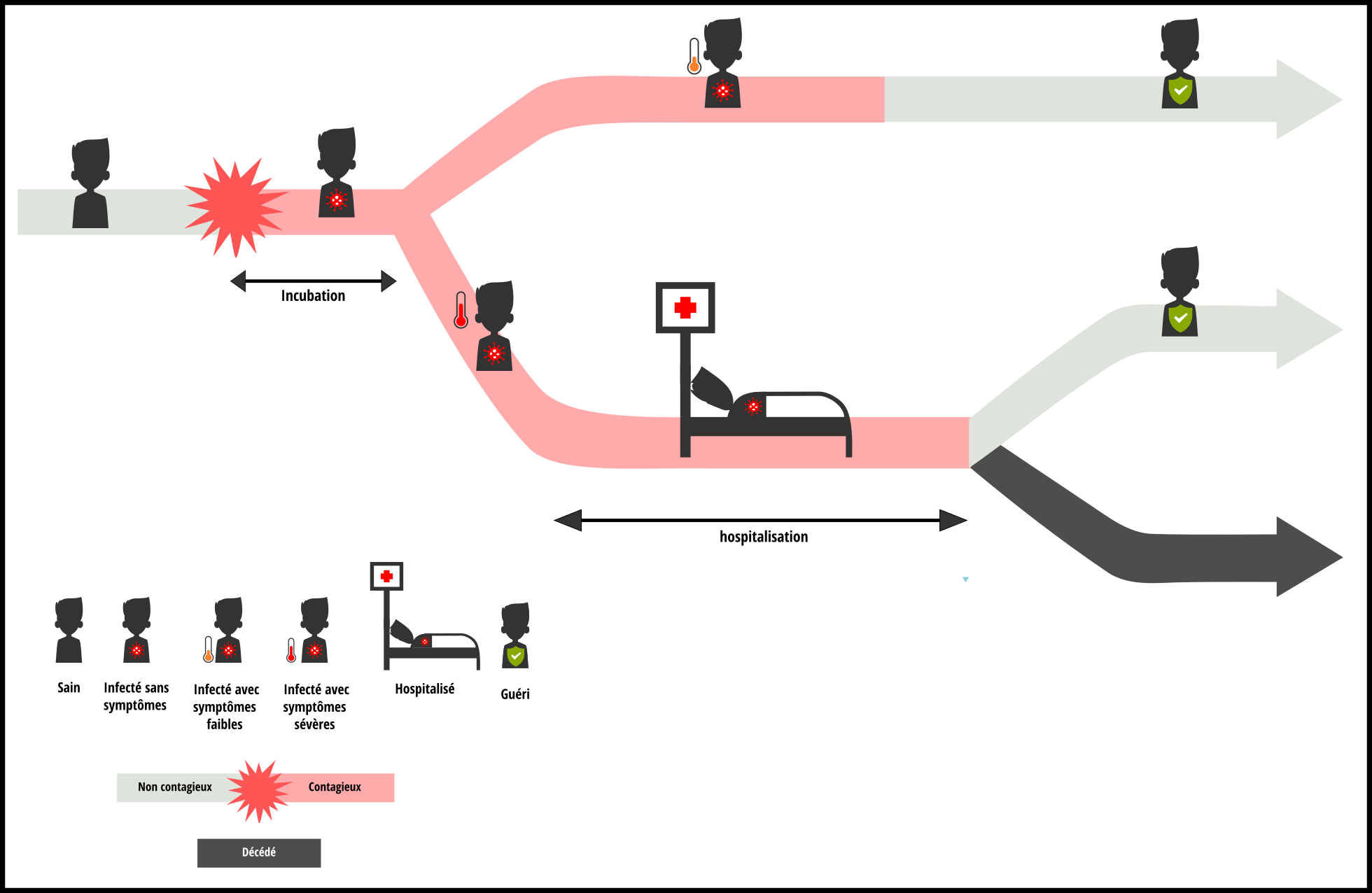
Pour évaluer comment la réduction de la vitesse de diffusion permet d’étaler le nombre d’infections dans le temps et de réduire la surcharge hospitalière, il faut également tenir compte des caractéristiques propres à chaque virus (et à la prise en charge médicale).
- Il y a d’abord la phase d’incubation qui correspond à la période où la personne est infectée (et potentiellement contagieuse) mais ne le sait pas encore.
- Ensuite, une phase d’hospitalisation peut être nécessaire pour les personnes dont l’état de santé se dégrade.
Ces différentes phases, qui s’enchaînent les unes après les autres, ont des durées plus ou moins longues selon les virus. La date à laquelle l’infection est détectée, la gravité des symptômes et leur durée sont variables et influencent fortement l’intensité et la durée de la surcharge hospitalière en cas d’épidémie. Bien sûr, d’autres facteurs comme le taux de cas graves nécessitant une hospitalisation ou le nombre de lits disponibles ont également un impact sur la pression exercée par l’épidémie sur le système de soins, mais ne nous en occupons pas pour l’instant. Concentrons-nous sur les durées des phases d’incubation et d’hospitalisation pour voir comment ces caractéristiques de la maladie modifient l’effet du ralentissement de la diffusion sur le pic de surcharge hospitalière.
Imaginons tout d’abord qu’on fasse varier la durée d’incubation (B) de la maladie (dont la durée moyenne a été fixée par défaut à 6 jours dans nos modèles, en lien avec ce qu’on sait de la COVID-19). Regardons alors comment le ralentissement de la transmission joue sur la surcharge hospitalière. On s’aperçoit que lorsque la période d’incubation de la maladie est plus courte (scénario B1 avec un durée moyenne d’incubation de 2 jours), la réduction de la transmission dès le premier cas hospitalisé permet de réduire efficacement la surcharge du système de soin : la durée de saturation de l’hôpital est de 4 jours, avec 76,5% des individus qui obtiennent le lit de réanimation dont ils ont besoin.
En revanche, en cas de longue période d’incubation (scénario B2 avec une durée moyenne d’incubation de 10 jours), freiner la transmission à partir du premier cas hospitalisé ne permet pas d’éviter la surcharge des hôpitaux. La durée de saturation de l’hôpital augmente pour atteindre 13 jours, et uniquement 34,1% des individus obtiennent le lit de réanimation dont ils ont besoin. Si la durée d’incubation est longue, l’infection a déjà eu le temps de se répandre au sein de la population lorsque le ralentissement de la diffusion se produit. Cela montre bien à quel point la phase d’incubation (et l’absence de symptomes qui l’accompagne) est un élément clef à prendre en compte lorsqu’on souhaite contrôler une épidémie et endiguer la surcharge hospitalière.
Scénario B1 avec une durée moyenne d’incubation de 2 jours
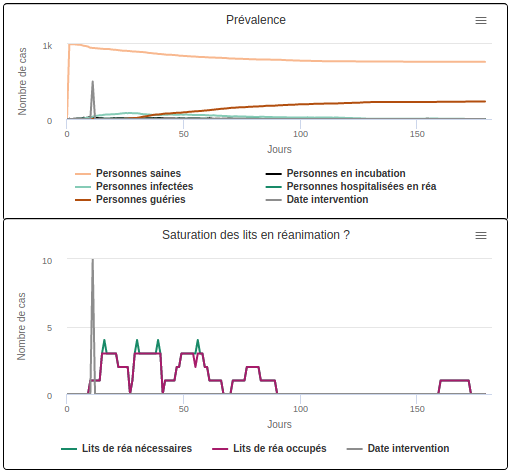
Scénario B2 avec une durée moyenne d’incubation de 10 jours
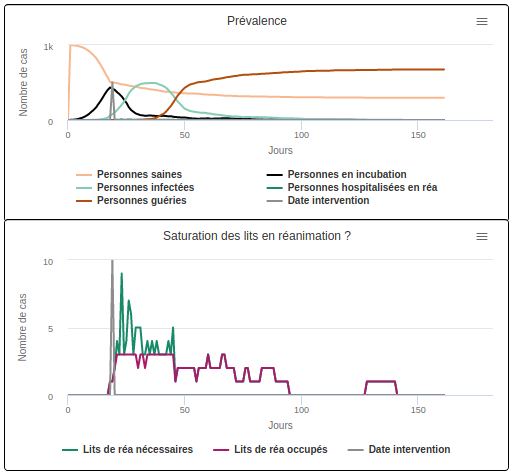
Imaginons ensuite qu’on fasse varier la durée d’hospitalisation en réanimation (C) dont la durée moyenne a été fixée par défaut à 12 jours dans nos modèles (en lien avec les traitements actuels pour la COVID-19). On s’aperçoit alors que plus les cas graves nécessitent d’être hospitalisés longtemps, plus la surcharge des hôpitaux dure longtemps. Le nombre de personnes qui nécessitent des soins spécialisés mais qui ne peuvent être prises en charge est alors plus élevé.
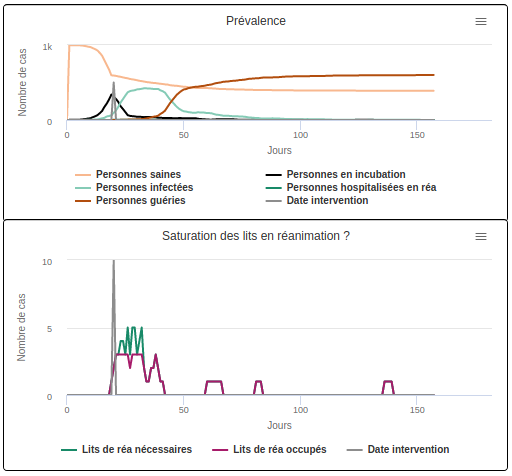
- Lorsque la durée d’hospitalisation est courte (3 jours), les hôpitaux sont saturés pendant 7 jours et 67,9% des malades obtiennent un lit (cf. scénario C1).
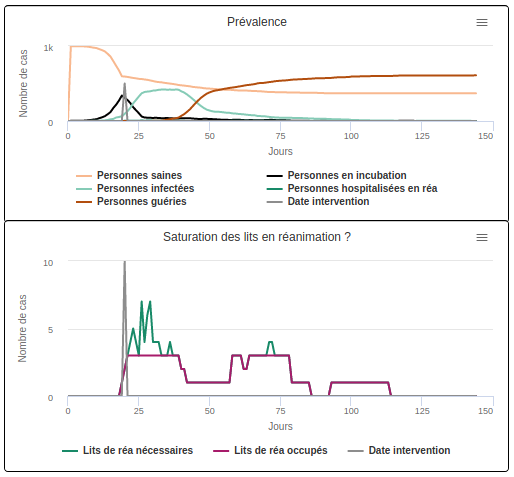
- Lorsque la durée d’hospitalisation est longue (21 jours), les hôpitaux sont saturés pendant 13 jours et 26,7% des malades obtiennent un lit (cf. scénario C2).
Ce résultat assez intuitif souligne bien que la surcharge hospitalière redoutée et observée actuellement avec la COVID-19 est étroitement liée à la longueur des soins hospitaliers que cette maladie exige.
Scénario C1 avec une durée moyenne d’hospitalisation de 3 jours
Scénario C2 avec une durée moyenne d’hospitalisation de 21 jours
Pour comparer les différents scénarios, nous nous sommes concentrés sur le nombre de jours de saturation et la proportion de malades qui ont obtenu un lit. Ces valeurs dépendent toutefois des paramètres du modèle et doivent être interprétées relativement les unes aux autres. Ce qui nous importe ici, c’est en effet de montrer dans quelle mesure et à quel moment la saturation des hôpitaux se produit.
Réduire la vitesse de diffusion d’un virus permet de soulager le système de soins. Mais l’efficacité de ce ralentissement varie selon le moment où la vitesse de transmission est réduite, la période pendant laquelle la maladie se diffuse silencieusement sans être détectée par le système de surveillance et la durée des soins que cette maladie nécessite. À vous de vous en convaincre en jouant avec le modèle ci-dessous, avec comme objectif de limiter la surcharge hospitalière !
Modèle pour simuler la surcharge hospitalière
Si la fenêtre du simulateur est tronquée à l’affichage, il vous suffit d’effectuer un zoom arrière
Remarque: Des outils construits par d’autres équipes ont aussi comme objectif de simuler la surcharge hospitalière, comme par exemple Modeling COVID-19 Spread vs Healthcare Capacity
Rappel : les modèles développés sur ce site sont des modèles pédagogiques, bien plus simples que les modèles construits et mis en oeuvre par d’autres équipes scientifiques travaillant sur la COVID-19. Ils ne se substituent pas à ces modèles de référence et ne peuvent pas être utilisés à leur place pour mener des expertises, diagnostics ou pronostics. Notre objectif est de contribuer à la création, au sein de la population, d’une meilleure connaissance des moteurs de cette épidémie qui nous concerne toutes et tous.